resumo
Dentre todos os aminoácidos transferidos para o feto via placenta, a glutamina é o aminoácido transferido em maior concentração. Além disso, a glutamina corresponde ao aminoácido mais abundante no leite materno. Contudo, o bebê nascido prematuramente sofre uma interrupção abrupta no suprimento materno-placentário de glutamina e, frequentemente, recebe apenas nutrição parenteral nas primeiras semanas de vida, a qual não contém glutamina. Cabe ainda destacar que neonatos prematuros e com baixo peso ao nascer possuem pouca massa muscular e, portanto, seus estoques de glutamina são limitados. A diminuição da concentração plasmática de glutamina pode acarretar em prejuízos para a integridade intestinal e para a função imune, uma vez que a glutamina é um substrato indispensável para enterócitos e leucócitos.
abstract
Amongst the amino acids transferred to the foetus via the placenta, glutamine is the one which is transferred at the greatest concentration. Furthermore, glutamine is the most abundant amino acid in maternal milk. Nevertheless, premature neonates suffer an abrupt interruption in the supply of glutamine, which was delivered through the placenta. These infants frequently receive only parenteral nutrition throughout the first weeks of life, which is free of glutamine. Premature neonates as well as those born with a low body weight are deficient in muscle mass and thus have a feeble reserve of glutamine. The decrease in plasma glutamine concentration can lead to impairments of the gastrointestinal tract and the immune system due to the indispensability of this amino acid to enterocytes and leukocytes.
introdução
A glutamina é o aminoácido livre mais abundante no plasma e no tecido muscular. Este aminoácido apresenta diversas funções únicas no organismo, fato que reforça seu papel relevante tanto em estados normais como fisiopatológicos. A glutamina é utilizada em altas taxas por células de divisão rápida, como enterócitos e leucócitos, para fornecer energia e para favorecer a biossíntese de nucleotídeos, além de atuar tanto no anabolismo protéico quanto na promoção do processo de adaptação e crescimento de tecidos altamente especializados (NEU, 1997; BALL; HARDY, 2002).
Neonatos são particularmente vulneráveis a infecções bacterianas, o que é decorrente de deficiências intrínsecas da sua resposta imune, sendo a septicemia uma das principais causas de morte em crianças. O processo infeccioso pode ocasionar diminuição da concentração plasmática e tecidual de glutamina, fato este que pode provocar alteração da funcionalidade de leucócitos (NEWSHOLME, 1999). Cabe ainda destacar que neonatos estão sujeitos a intenso crescimento, o que faz com que apresentem maior turnover protéico, processo que pode acarretar em maior utilização de glutamina (BALL; HARDY, 2002). Uma vez que a glutamina é um substrato indispensável para enterócitos e células do sistema imune, e que neonatos prematuros estão sujeitos a intenso crescimento e a inúmeros estresses fisiológicos, sugere-se que a glutamina seja um aminoácido condicionalmente essencial nessa fase da vida (NEU; SHENOY; CHAKRABARTI, 1996).
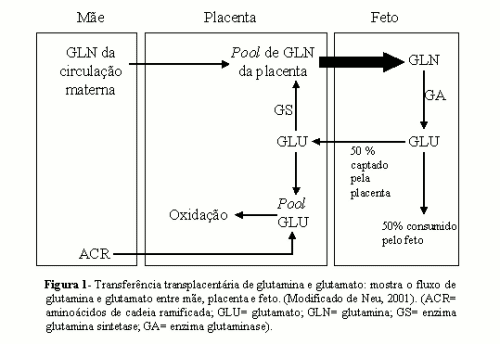
O transporte e o metabolismo da glutamina e do glutamato durante o desenvolvimento fetal possuem características únicas. A glutamina é o aminoácido transferido em maior concentração para o feto (NEU, 2001). Estudos realizados em ovelhas durante a gestação estimam que cerca de 19% de todo o nitrogênio captado pelo feto seja derivado da glutamina (BATTAGLIA, 2000). A glutamina liberada na circulação fetal é proveniente não só da circulação materna, como também da síntese placentária (NEU, 2001). No feto, a glutamina é captada pelo fígado e cerca de 45% desse aminoácido são convertidos a glutamato. Em seguida, o glutamato sintetizado é captado pela placenta. A maior parte do glutamato é oxidada na placenta, mas parte deste é convertido à glutamina, em uma reação catalisada pela enzima glutamina sintetase, e devolvido à circulação fetal (BATTAGLIA, 2000) (figura 1).
Ao nascer, o fluxo transplacentário de glutamina é interrompido e o bebê passa a depender de sua síntese endógena e/ou do fornecimento exógeno de glutamina. Bebês amamentados ingerem glutamina por meio do leite materno, o qual contém um pool de aminoácidos livres duas a cinco vezes maior quando comparado às formulas infantis comercializadas atualmente (AGOSTONI, 2000a). Todavia, com a progressão da lactação, observa-se diminuição significante da concentração da maioria dos aminoácidos livres presentes no leite materno, ao mesmo tempo em que a concentração de glutamina e glutamato – que representam 50% do total de aminoácidos livres no leite materno – aumenta aproximadamente 2,0 e 2,5 vezes, respectivamente, durante os três primeiros meses de lactação (AGOSTONI, 2000a; AGOSTONI, 2000b). Além disso, estudos demonstram que tanto no colostro quanto no leite materno, dos aminoácidos ligados à proteína, glutamina e glutamato representam aqueles de maior concentração (DAVIS; FIOROTTO; REEDS, 1993; DAVIS, 1994; WU; KNABE, 1994). Cabe ressaltar que a concentração de glutamina livre do leite materno é, aproximadamente, 10 vezes superior àquela encontrada em fórmulas infantis (AGOSTONI , 2000a).
O bebê nascido prematuramente sofre uma interrupção abrupta no suprimento materno e placentário de glutamina, o que lhe acarreta dependência exclusiva da síntese endógena ou do fornecimento exógeno deste aminoácido. Conforme citado anteriormente, o leite materno possui alta concentração de glutamina. No entanto, neonatos pré-termo e com baixo peso ao nascer, frequentemente, recebem apenas nutrição parenteral total nas primeiras semanas de vida, a qual não contém glutamina. Cabe ainda destacar que esses bebês possuem pouca massa muscular e, portanto, uma vez que o músculo esquelético é o principal tecido de síntese, armazenamento e liberação de glutamina, seus estoques de glutamina são limitados. Dessa forma, é possível inferir que neonatos prematuros e com baixo peso ao nascer recebendo nutrição parenteral total estão sob grande risco de sofrer depleção de seus estoques de glutamina, fenômeno que pode acarretar em prejuízo da função imune e da integridade intestinal.
suplementação parenteral com glutamina
Apesar de estar envolvida em inúmeros processos metabólicos e ser o aminoácido transferido em maior concentração para o feto, a glutamina não é adicionada rotineiramente à mistura de aminoácidos de fórmulas parenterais comerciais. Este fato deve-se à limitada solubilidade da glutamina em água (35g/L de água, a 20 oC) (FURST, 2001), bem como à possível neurotoxicidade decorrente da decomposição do aminoácido em um produto cíclico, ácido piroglutâmico, e amônia (FURST; ALBERS; STEHLE, 1990). Uma alternativa que possibilita a adição de glutamina a fórmulas parenterais consiste na utilização de dipeptídeos contendo glutamina, como o L-alanil-L-glutamina, que permanece estável durante a esterilização com calor e é altamente solúvel em água (568 g/L) (FURST, 2001).
Estudos demonstram que a administração de glutamina por via parenteral atua principalmente no metabolismo protéico do músculo esquelético (PARIMI; KALHAN, 2007). A glutamina estimula a síntese e inibe a degradação protéica, processo que poderia contribuir para a obtenção de um balanço protéico muscular positivo em situações catabólicas (HAMMARQVIST, 1989; ZIEGLER, 1992). Nesse contexto, o efeito da suplementação parenteral com glutamina no metabolismo protéico de neonatos pré-termo foi avaliado por dois estudos (DES ROBERT, 2002; KALHAN, 2005). Os bebês foram aleatoriamente selecionados para receber suplementação com glutamina intravenosa ou uma mistura de aminoácidos isonitrogenada isenta de glutamina. Des Robert et al. (2002) suplementaram neonatos prematuros com 0,5 g de glutamina/kg/dia por 24 horas, ao passo que Kalhan et al. (2005) utilizaram uma dose maior (0,6g/kg/dia), bem como um tempo de suplementação mais prolongado (72 a 120 horas), sendo que, em ambos os estudos, observou-se diminuição da degradação protéica em relação ao grupo controle.
Todavia, apesar dos estudos anteriores demonstrarem efeito positivo da suplementação intravenosa com glutamina sobre o metabolismo protéico de neonatos prematuros, os efeitos dessa intervenção na prática clínica permanecem controversos. Nesse contexto, Lacey et al. (1996) observaram que a administração intravenosa de glutamina resultou em diminuição do tempo de ventilação mecânica e da nutrição parenteral total, bem como do tempo necessário para atingir a nutrição enteral exclusiva em neonatos com peso ao nascer menor que 800 g (LACEY, 1996). No entanto, esses resultados não foram confirmados por um estudo multicêntrico. Nesse estudo, 1.433 neonatos foram aleatoriamente distribuídos para receber nutrição parenteral suplementada com uma solução de aminoácidos contendo 20% de glutamina (1.400 mg/ 100 ml de solução) ou uma mistura isonitrogenada de aminoácidos. A suplementação resultou em aumento de 30% da concentração plasmática de glutamina ao final do protocolo no grupo suplementado. Apesar do aumento da concentração plasmática de glutamina sugerir aumento da disponibilidade desse aminoácido para os tecidos, não foi observada redução na incidência de sepse tardia, mortalidade, enterocolite necrosante e do tempo de hospitalização ou ventilação mecânica (POINDEXTER, 2004). Por outro lado, cabe ressaltar que, para que os grupos recebessem misturas de aminoácidos isonitrogenadas, o grupo suplementado com glutamina recebeu menor quantidade dos outros aminoácidos, incluindo os essenciais, o que pode ter interferido nos resultados observados. Nenhum dos estudos utilizando suplementação parenteral com glutamina observou toxicidade decorrente da suplementação (DES ROBERT, 2002; KALHAN, 2005; LACEY , 1996; POINDEXTER , 2004).
suplementação enteral com glutamina
A nutrição enteral para neonatos de muito baixo peso representa um desafio à prática clínica, já que a demanda metabólica é alta, mas a administração da dieta enteral é limitada devido à imaturidade do trato digestório, fato que resulta em alta susceptibilidade à intolerância alimentar e ao desenvolvimento de enterocolite necrosante (NEU, WEISS, 1999).
A dieta enteral fornece glutamina por meio das proteínas, entretanto, a quantidade fornecida é pequena, visto que a dieta enteral é limitada nas primeiras semanas de vida (KUHN; STEHLE; FURST, 1996). Dessa forma, neonatos pré-termo ou com baixo peso ao nascer submetidos à nutrição enteral recebem uma pequena quantidade de glutamina durante esse período, o que estimulou a realização de ensaios clínicos acerca da suplementação enteral com glutamina nessa população.
Estudos em bebês pré-termo demonstram que a glutamina administrada via enteral é principalmente consumida pela mucosa intestinal e, portanto, apenas uma parte atinge a circulação sanguínea (DARMAUN, 1997; PARIMI, 2004). Adicionalmente, além de ter acesso à glutamina presente no lúmen intestinal, que atravessa a membrana borda em escova do enterócito, o intestino também pode captar a glutamina presente no sangue arterial por meio da membrana basolateral do enterócito (WINDMUELLER; SPAETH, 1985). Dessa forma, é possível inferir que a glutamina administrada via enteral é amplamente metabolizada pela mucosa intestinal e, portanto, o principal efeito da suplementação enteral ocorre no intestino, tanto em relação à sua integridade e permeabilidade quanto ao seu componente imune (PARIMI; KALHAN, 2007).
Em razão da glutamina desempenhar papel importante na manutenção da integridade intestinal e na função imune, alguns estudos clínicos foram realizados para avaliar se a suplementação enteral com glutamina em neonatos com baixo peso ao nascer diminuiria a incidência de morbidades infecciosas, como a sepse nosocomial — ou seja, a sepse adquirida em meio hospitalar, condição que ocorre frequentemente em neonatos de baixo peso ao nascer durante a fase de convalescença de sua hospitalização. Essas infecções nosocomiais estão associadas com significativas taxas de morbidade e mortalidade (MAKHOUL, 2002).
Neu et al. (1997) observaram menor incidência de sepse nosocomial no grupo recebendo dieta enteral suplementada com 0,3 g de glutamina/kg/dia, durante 28 dias, em relação ao grupo controle. Todavia, é relevante destacar que o número de participantes do estudo foi pequeno (n=68) e que o grupo controle não recebeu uma dieta isonitrogenada. Dessa forma, os resultados encontrados podem ter sido influenciados pela maior ingestão de proteína (até 0,31g/kg/dia) e de nitrogênio no grupo suplementado com glutamina. Em outro estudo, o mesmo protocolo de suplementação foi utilizado (0,3 g de glutamina/kg/dia por 28 dias), entretanto, o grupo controle recebeu uma mistura isonitrogenada contendo alanina. Assim como no estudo de Neu et al. (1997), a incidência de sepse no grupo que recebeu nutrição enteral suplementada com glutamina foi menor em relação ao controle (VAN DEN BERG, 2005).
Neonatos prematuros podem ter permeabilidade intestinal aumentada devido à imaturidade de seu trato digestório, o que, por sua vez, aumenta a susceptibilidade à translocação bacteriana, predispondo à ocorrência de sepse. Dessa forma, Van Den Berg et al. (2006) investigaram se a suplementação enteral com glutamina resultaria em melhora da integridade intestinal, fenômeno que levaria à diminuição da permeabilidade intestinal, fato que poderia justificar a menor incidência de sepse observada no grupo suplementado com este aminoácido. Contudo, não foi observada redução da permeabilidade intestinal em resposta à suplementação enteral com 0,3 g de glutamina/kg/dia. Apesar de algumas limitações metodológicas, os autores concluíram que a redução da incidência de sepse, observada nos estudos anteriores, após a suplementação enteral com glutamina, envolve outros aspectos, como a modulação da resposta inflamatória intestinal por este aminoácido (VAN DEN BERG, 2006).
A relação entre a incidência de sepse e a suplementação enteral com glutamina também foi investigada por um ensaio clínico, multicêntrico, com 649 participantes (VAUGH, 2003). Ao contrário dos estudos anteriores, não foi observada diferença na incidência de sepse em neonatos suplementados com glutamina (0,3 g/kg/dia), por 28 dias, em comparação ao grupo placebo (água estéril). No entanto, a dose suplementada foi baseada no peso ao nascimento e não foi ajustada para o peso real. Consequentemente, a quantidade de glutamina fornecida pode ter sido insuficiente, devido ao rápido ganho de peso pós-natal. Além disso, similarmente aos estudos realizados por Van Den Berg et al. (2005) e Van Den Berg et al. (2006), parte dos bebês em ambos os grupos recebeu glutamina por meio do leite materno e, portanto, o grupo controle não foi privado de suprimento exógeno de glutamina. A quantidade de glutamina no leite materno não foi dosada em nenhum dos estudos e, portanto, não é possível estimar a quantidade de glutamina ingerida pelo grupo controle.
Outro possível benefício decorrente da suplementação enteral com glutamina seria a melhora da tolerância à dieta enteral, resultante da aceleração no desenvolvimento intestinal e/ou da redução da incidência de infecção. Nesse contexto, verificou-se que a suplementação enteral com glutamina promoveu melhora na tolerância à dieta enteral em dois estudos (NEU, 1997; VAUGHN, 2003), mas esse resultado não foi confirmado pelo estudo de Van Den Berg et al. (2005).
Outros parâmetros avaliados pelos ensaios clínicos envolvendo suplementação enteral com glutamina são crescimento físico, incidência de enterocolite necrosante e tempo de hospitalização. No entanto, não tem sido observado melhora no crescimento, na diminuição da incidência de enterocolite necrosante ou no tempo de hospitalização em bebês suplementados com glutamina (NEU, 1997; VAUGHN, 2003; VAN DEN BERG, 2005).
Da mesma forma que os estudos envolvendo suplementação parenteral com glutamina, nenhum dos estudos realizados com suplementação enteral com glutamina observou toxicidade decorrente da suplementação (NEU, 1997; VAUGHN, 2003; VAN DEN BERG, 2005; VAN DEN BERG, 2006).
conclusão
A glutamina desempenha função importante em inúmeros processos celulares e, portanto, neonatos possivelmente dependem de fornecimento adequado de glutamina para o crescimento normal e para a manutenção de funções fisiológicas, como a resposta imune e a integridade intestinal. De fato, alguns ensaios clínicos demonstraram benefícios da suplementação com glutamina em neonatos prematuros e com baixo peso ao nascer. Em contrapartida, esses resultados não foram reproduzidos por estudos multicêntricos. É possível que diferenças na quantidade de aminoácidos oferecida para os grupos e a heterogeneidade da população em questão sejam parcialmente responsáveis pelas discrepâncias encontradas. Dessa forma, acredita-se que mais estudos sejam necessários para confirmar se a suplementação com glutamina, realmente, beneficia neonatos pré-termo e com baixo peso ao nascer, bem como para esclarecer qual via de administração (enteral ou parenteral) é mais vantajosa para essa população.
referências
AGOSTONI, C. et al. Free amino acid content in standard infant formulas: comparison with human milk. J. Am. Coll. Nutr., v.19, n.4, p.434-438, 2000a.
AGOSTONI, C. et al. Free glutamine and glutamic acid increase in human milk through a three-month lactation period. J. Pediatr. Gastroenterol. Nutr., v.31, n.5, p.508-512, 2000b.
BALL, P.A.; HARDY, G. Glutamine in pediatrics: where next? Nutrition, v.18, n.6, p.451-454, 2002.
BATTAGLIA, F.C. Glutamine and glutamate exchange between the fetal liver and the placenta. J. Nutr., v.130, n.4S, p.974S-977S, 2000.
DARMAUN, D. et al. Glutamine metabolism in very low birth weight infants. Pediatr. Res., v.41, n.3, p.391-396, 1997.
DAVIS, T.A.; FIOROTTO, M.L.; REEDS, P.J. Amino acid compositions of body and milk protein change during the suckling period in rats. J. Nutr., v.123, n.5, p.947-956, 1993.
DAVIS, T.A. et al. Amino acid composition of the milk of some mammalian species changes with stage of lactation. Br. J. Nutr., v.72, n.6, p.845-853, 1994.
DES ROBERT, C. et al. Acute effects of intravenous glutamine supplementation on protein metabolism in very low birth weight infants: a stable isotope study. Pediatr. Res., v.51, n.1, p.87-93, 2002.
FURST, P. New developments in glutamine delivery. J. Nutr., v.131, n.9S, p.2562S-2568S, 2001.
FURST, P.; ALBERS, S.; STEHLE, P. Glutamine-containing dipeptides in parenteral nutrition. JPEN, v.14, n.4S, p.118S-124S, 1990.
HAMMARQVIST, F. et al. Addition of glutamine to total parenteral nutrition after elective abdominal surgery spares free glutamine in muscle, counteracts the fall in muscle protein synthesis, and improves nitrogen balance. Ann. Surg., v.209, n.4, p.455-461, 1989.
KALHAN, S.C. et al. Glutamine supplement with parenteral nutrition decreases whole body proteolysis in low birth weight infants. J. Pediatr., v.146, n.5, p.642-647, 2005.
KUHN, K.S.; STEHLE, P.; FURST, P. Glutamine content of protein and peptide-based enteral products. JPEN, v.20, n.4, p.292-295, 1996.
LACEY, J.M. et al. The effects of glutamine-supplemented parenteral nutrition in premature infants. JPEN, v.20, n.1, p.74-80, 1996.
MAKHOUL, I.R. et al. Epidemiological, clinical, and microbiological characteristics of late-onset sepsis among very low birth weight infants in Israel: a national survey. Pediatrics, v.109, n.1, p. 34-39, 2002.
NEU, J. Glutamine in the fetus and critically ill low birth weight neonate: metabolism and mechanism of action. J. Nutr., v.131, n.9S, p.2585S-2589S, 2001.
NEU, J. et al. Enteral glutamine supplementation for very low birth weight infants decreases morbidity. J. Pediatr., v.131, n.5, p.691-699, 1997.
NEU, J.; SHENOY, V.; CHAKRABARTI, R. Glutamine nutrition and metabolism: where do we go from here? FASEB J., v.10, n.8, p.829-837, 1996.
NEU, J.; WEISS, M.D. Necrotizing enterocolitis: pathophysiology and prevention. JPEN, v.23, n.5S, p.S13-S17, 1999.
NEWSHOLME, P. et al. Glutamine metabolism by lymphocytes, macrophages, and neutrophils: its importance in health and disease. J. Nutr. Biochem., v.10, n.6, p.316-324, 1999.
PARIMI, P.S. et al. Effect of enteral glutamine or glycine on whole-body nitrogen kinetics in very-low-birth-weight infants. Am. J. Clin. Nutr., v.79, n.3, p.402-409, 2004.
PARIMI, P.S.; KALHAN, S.C. Glutamine supplementation in the newborn infant.
Semin. Fetal Neonatal. Med., v.12, n.1, p.19-25, 2007.
POINDEXTER, B.B. et al. Parenteral glutamine supplementation does not reduce the risk of mortality or late-onset sepsis in extremely low birth weight infants. Pediatrics, v.113, n.5, p.1209-1215, 2004.
VAN DEN BERG, A. et al. Glutamine-enriched enteral nutrition in very-low-birth-weight infants and effects on feeding tolerance and infectious morbidity: a randomized controlled trial. Am. J. Clin. Nutr., v.81, n.6, p.1397-1404, 2005.
VAN DEN BERG, A. et al. The effect of glutamine-enriched enteral nutrition on intestinal permeability in very-low-birth-weight infants: a randomized controlled trial. JPEN, v.30, n.5, p.408-414, 2006.
VAUGHN, P. et al. Enteral glutamine supplementation and morbidity in low birth weight infants. J. Pediatr., v.142, n.6, p.662-668, 2003.
WINDMUELLER, H.G.; SPAETH, A.E. Intestinal metabolism of glutamine and glutamate from the lumen as compared to glutamine from blood. Arch. Biochem. Biophys., v.171, n.2, p.662-672, 1975.
WU, G.; KNABE, D.A. Free and protein-bound amino acids in sow’s colostrum and milk. J. Nutr., v.124, n.3, p.415-424, 1994.
ZIEGLER, T.R. et al. Clinical and metabolic efficacy of glutamine-supplemented parenteral nutrition after bone marrow transplantation. Ann. Intern. Med., v.116, n.10, p.821-828, 1992.
Recebido: 07/02/2005 - Aprovado: 15/03/2007
 Glutamina: um Possível Nutriente Condicionalmente Essencial para Neonatos Pré-Termo e com Baixo Peso ao Nascer
Glutamina: um Possível Nutriente Condicionalmente Essencial para Neonatos Pré-Termo e com Baixo Peso ao Nascer




Post a Comment